Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое Калориметр - определение
Найдено результатов: 21
КАЛОРИМЕТР
(от лат. calor - тепло и ...метр), прибор для измерения количеств теплоты, выделяющейся или поглощающейся при различных физических, химических или биологических процессах.
калориметр
м.
Прибор для измерения количества теплоты, выделяющейся или поглощаемой при каком-л. физическом, химическом или биологическом процессе.
Прибор для измерения количества теплоты, выделяющейся или поглощаемой при каком-л. физическом, химическом или биологическом процессе.
КАЛОРИМЕТР
прибор для измерения количества теплоты.
КАЛОРИМЕТР
а, м.
Прибор для определения количества теплоты, выделяемой или поглощаемой при каком-н. физиче-ском, химическом или биологическом процессе.
калориметр
муж. снаряд для определения степени теплоты, тепломер; или снаряд для скопленья, сосредоточенья теплоты; теплохранитель. Калорифер, печь, топка; вообще снаряд для согреванья комнат.
калориметр
Калориметр
(от лат. calor - тепло и ...метр)
прибор для измерения количества теплоты, выделяющейся или поглощающейся в каком-либо физическом, химическом или биологическом процессе. Термин "К." был предложен А. Лавуазье и П. Лапласом (1780).
Современные К. работают в диапазоне температур от 0,1 до 3500 К и позволяют измерять количество теплоты с точностью до 10-2\%. Устройство К. весьма разнообразно и определяется характером и продолжительностью изучаемого процесса, областью температур, при которых производятся измерения, количеством измеряемой теплоты и требуемой точностью.
К., предназначенный для измерения суммарного количества теплоты Q, выделяющейся в процессе от его начала до завершения, называют К.-интегратором; К. для измерения тепловой мощности L и её изменения на разных стадиях процесса - измерителем мощности или К.-осциллографом. По конструкции калориметрической системы и методу измерения различают жидкостные и массивные К., одинарные и двойные (дифференциальные).
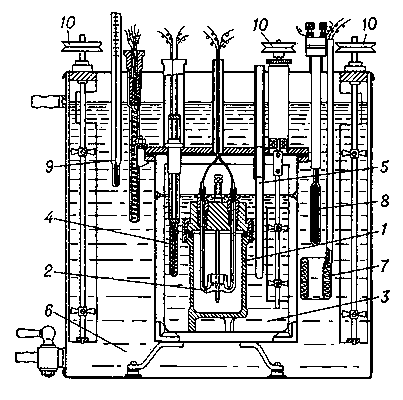
Жидкостный К.-интегратор переменной температуры (рис. 1) с изотермической оболочкой применяют для измерений теплот растворения и теплот химических реакций. Он состоит из сосуда с жидкостью (обычно водой), в котором находятся: камера для проведения исследуемого процесса ("калориметрическая бомба"), мешалка, нагреватель и термометр. Теплота, выделившаяся в камере, распределяется затем между камерой, жидкостью и др. частями К., совокупность которых называют калориметрической системой прибора. Изменение состояния (например, температуры) калориметрической системы позволяет измерить количество теплоты, введённое в К. Нагрев калориметрической системы фиксируется термометром. Перед проведением измерений К. градуируют - определяют изменение температуры калориметрической системы при сообщении ей известного количества теплоты (нагревателем К. или в результате проведения в камере химической реакции с известным количеством стандартного вещества). В результате градуировки получают тепловое значение К., т. е. коэффициент, на который следует умножить измеренное термометром изменение температуры К. для определения количества введённой в него теплоты. Тепловое значение такого К. представляет собой Теплоёмкость (с) калориметрической системы. Определение неизвестной теплоты сгорания или др. химической реакции Q сводится к измерению изменения температуры Δt калориметрической системы, вызванного исследуемым процессом: Q = c․Δt. Обычно значение Q относят к массе вещества, находящегося в камере К.
Калориметрические измерения позволяют непосредственно определить лишь сумму теплот исследуемого процесса и различных побочных процессов, таких как перемешивание, испарение воды, разбивание ампулы с веществом и т.п. Теплота побочных процессов должна быть определена опытным путём или расчётом и исключена из окончательного результата. Одним из неизбежных побочных процессов является Теплообмен К. с окружающей средой посредством излучения и теплопроводности. В целях учёта побочных процессов и прежде всего теплообмена калориметрическую систему окружают оболочкой, температуру которой регулируют.
У жидкостных изотермическую К. температуру оболочки поддерживают постоянной. При определении теплоты химической реакции наибольшие затруднения часто связаны не с учётом побочных процессов, а с определением полноты протекания реакции и с необходимостью учитывать несколько реакций.
В К.-интеграторе другого вида - изотермическом (постоянной температуры) введённая теплота не изменяет температуры калориметрической системы, а вызывает изменение агрегатного состояния тела, составляющего часть этой системы (например, таяние льда в ледяном калориметре Бунзена). Количество введённой теплоты рассчитывается в этом случае по массе вещества, изменившего агрегатное состояние (например, массе растаявшего льда, которую можно измерить по изменению объёма смеси льда и воды), и теплоте фазового перехода (См. Теплота фазового перехода).
Массивный К.-интегратор чаще всего применяют для определения энтальпии (См. Энтальпия) веществ при высоких температурах (до 2500 °С). Калориметрическая система у К. этого типа представляет собой блок из металла (обычно из меди или алюминия) с выемками для сосуда, в котором происходит реакция, для термометра и нагревателя. Энтальпию вещества рассчитывают как произведение теплового значения К. на разность подъёмов температуры блока, измеряемых после сбрасывания в его гнездо ампулы с определённым количеством вещества, а затем пустой ампулы, нагретой до той же температуры.
Теплоёмкость газов, а иногда и жидкостей, определяют в т. н. проточных лабиринтных К. - по разности температур на входе и выходе стационарного потока жидкости или газа, мощности этого потока и джоулевой теплоте, выделенной электрическим нагревателем К.
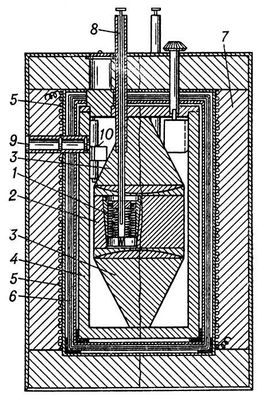
К., работающий как измеритель мощности, в противоположность К.-интегратору должен обладать значительным теплообменом, чтобы вводимые в него количества теплоты быстро удалялись и состояние К. определялось мгновенным значением мощности теплового процесса. Тепловая мощность процесса находится из теплообмена К. с оболочкой. Такие К. (рис. 2), разработанные французским физиком Э. Кальве (Е. Calvet, 1895-1966), представляют собой металлический блок с каналами, в которые помещают цилиндрические ячейки. В ячейке проводится исследуемый процесс; металлический блок играет роль оболочки (температура его поддерживается постоянной с точностью до 10-5-10-6 К). Разность температур ячейки и блока измеряется термобатареей, имеющей до 1000 спаев. Теплообмен ячейки и эдс термобатареи пропорциональны малой разности температур, возникающей между блоком и ячейкой, когда в ней выделяется или поглощается теплота. В блок помещают чаще всего две ячейки, работающие как дифференциальный К.: термобатареи каждой ячейки имеют одинаковое число спаев и поэтому разность их эдс позволяет непосредственно определить разность мощности потоков теплоты, поступающей в ячейки. Этот метод измерений позволяет исключить искажения измеряемой величины случайными колебаниями температуры блока. На каждой ячейке монтируют обычно две термобатареи: одна позволяет скомпенсировать тепловую мощность исследуемого процесса на основе Пельтье эффекта, а другая (индикаторная) служит для измерения нескомпенсированной части теплового потока. В этом случае прибор работает как дифференциальный компенсационный К. При комнатной температуре такими К. измеряют тепловую мощность процессов с точностью до 1 мквт.
Обычные названия К. - "для химической реакции", "бомбовый", "изотермический", "ледяной", "низкотемпературный" - имеют историческое происхождение и указывают главным образом на способ и область использования К., не являясь ни полной, ни сравнительной их характеристикой.
Общую классификацию К. можно построить на основе рассмотрения трёх главных переменных, определяющих методику измерений: температуры калориметрической системы Tc; температуры оболочки To, окружающей калориметрическую систему количества теплоты L, выделяемой в К. в единицу времени (тепловой мощности).
К. с постоянными Tc и To называют изотермическим; с Tc = To - адиабатическим; К., работающий при постоянной разности температур Tc - To, называют К. с постоянным теплообменом; у изопериболического К. (его ещё называют К. с изотермической оболочкой) постоянна To, а Tc является функцией тепловой мощности L.
Важным фактором, влияющим на окончательный результат измерений, является надёжная работа автоматических регуляторов температуры изотермических или адиабатических оболочек. В адиабатическом К. температура оболочки регулируется так, чтобы она была всегда близка к меняющейся температуре калориметрической системы. Адиабатическая оболочка - лёгкая металлическая ширма, снабженная нагревателем, - уменьшает теплообмен настолько, что температура К. меняется лишь на несколько десятитысячных град/мин. Часто это позволяет снизить теплообмен за время калориметрического опыта до незначительной величины, которой можно пренебречь. В случае необходимости в результаты непосредственных измерений вводится поправка на теплообмен, метод расчёта которой основан на законе теплообмена Ньютона - пропорциональности теплового потока между К. и оболочкой разности их температур, если эта разность невелика (до 3-4 °С).
Для К. с изотермической оболочкой теплоты химической реакции могут быть определены с погрешностью до 0,01\%. Если размеры К. малы, температура его изменяется более чем на 2-3 °С и исследуемый процесс продолжителен, то при изотермической оболочке поправка на теплообмен может составить 15-20\% от измеряемой величины и существенно ограничить точность измерений. В этих случаях целесообразнее применять адиабатическую оболочку.
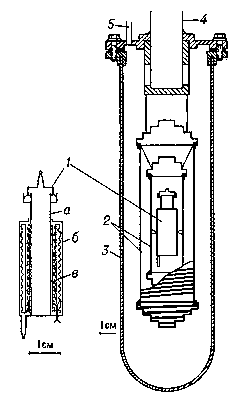
При помощи адиабатического К. определяют теплоёмкость твёрдых и жидких веществ в области от 0,1 до 1000 К. При комнатных и более низких температурах адиабатический К., защищенный вакуумной рубашкой, погружают в Дьюара сосуд (См. Дьюара сосуды), заполненный жидким гелием, водородом или азотом (рис. 3). При повышенных температурах (выше 100 °С) К. помещают в термостатированную электрическую печь.
Лит.: Попов М. М., Термометрия и калориметрия, 2 изд., М., 1954; Скуратов С. М., Колосов В. П., Воробьев А. Ф., Термохимия, ч. 1-2, М., 1964-66; Кальве Э., Прат А., Микро-калориметрия, пер. с франц., М., 1963; Experimental thermochemistry, v. 1-2 N. Y. - L., 1956-62.
В. А. Соколов.
Рис. 1. Жидкостный калориметр-интегратор с изотермической оболочкой (схема): 1 - "калориметрическая бомба"; 2 - нагреватель для возбуждения реакции; 3 - собственно калориметр (сосуд, заполненный водой); 4 - термометр сопротивления; 5 - холодильник (трубка, через которую можно пропускать холодный воздух); 6 - изотермическая оболочка калориметра, заполненная водой; 7 - нагреватель оболочки; 8 - контактный термометр для регулировки температуры оболочки; 9 - контрольный термометр; 10 - мешалки с приводом.

Рис. 2. Калориметр Э. Кальве для измерения тепловой мощности процессов (схема): 1 - калориметрическая ячейка с термопарами; 2 - блок калориметра; 3 - металлические конусы для создания однородного поля температур в блоке; 4 - оболочка; 5 - нагреватель для термостатирования прибора; 6 - тепловые экраны; 7 - тепловая изоляция; 8 - трубка для введения вещества в калориметр; 9 - окно для отсчётов показаний гальванометра 10.
Рис. 3. Адиабатический калориметр для определения теплоёмкости при низких температурах (схема): 1 - калориметр (а - сосуд для вещества, б - термометр сопротивления, в - нагреватель); 2 - адиабатические оболочки (ширмы); 3 - вакуумная рубашка; 4 - труба для откачки; 5 - трубка для электрических проводов.
Калориметр ионизационный
ИЗМЕРИТЕЛЬНОЕ УСТРОЙСТВО, ИСПОЛЬЗУКМОЕ В ЭКСПЕРИМЕНТАХ В ОБЛАСТИ ЯДЕРНОЙ ФИЗИКИ И ФИЗИКИ ЭЛЕМЕНТАРНЫХ ЧАСТИЦ ДЛЯ ИЗМЕРЕНИЯ ЭНЕРГИИ ЧАСТИ
Калориметр (ядерная физика); Калориметр (физика элементарных частиц); Калориметр ионизационный; Гетерогенный калоример; Гетерогенные калоримеры; Семплинг-калориметр; Семплинг-калориметры; Сэмплинг-калориметр; Сэмплинг-калориметры; Гомогенный калоример; Гомогенные калоримеры; Электромагнитный калориметр; Электромагнитные калориметры; Адронный калориметр; Адронные калориметры
прибор для определения энергии частиц космических лучей (См. Космические лучи) (Калориметр ионизационный1011 эв и выше). В К. и. энергия космические частицы поглощается в толстом слое вещества (подобно тому, как в обычном Калориметре поглощается тепло). Космические частицы высоких энергий при взаимодействии с веществом в результате ядерных реакций (См. Ядерные реакции) рождают большое число вторичных частиц или фотонов, которые в свою очередь образуют новые частицы и т.д. В конечном итоге образуется лавина заряженных частиц, которая движется в веществе, ионизует его атомы и при этом теряет свою энергию. Если толщина слоя поглощающего вещества достаточно велика и лавина заряженных частиц полностью остаётся в нём, то количество созданных в веществе ионов пропорционально энергии первичной космической частицы. Для измерения полного числа ионов поглотитель из плотного вещества (обычно - железо или свинец) разбивается на ряд слоев толщиной в несколько см, между которыми размещаются ионизационные камеры (См. Ионизационная камера).
К. и. был изобретён в 1954 в СССР, после чего он стал широко применяться как в СССР, так и за рубежом для изучения взаимодействий космических частиц высоких энергий (1011-1013 эв) с атомными ядрами. При этом К. и. обычно объединяют с приборами, позволяющими наблюдать результаты этого взаимодействия, - Вильсона камерами, ядерными фотографическими эмульсиями (См. Ядерная фотографическая эмульсия) (рис. 1), искровыми камерами (См. Искровая камера). Типичные габариты К. и.: высота 1,5-2 м, площадь поперечного сечения Калориметр ионизационный 1 м2, масса 10-20 т. В СССР в 1964 на высокогорной станции на г. Арагац в Армении построен и работает уникальный К. и. площадью 10 м2 и массой 70 т (рис. 2). К. и. применялся в СССР (1965-68) также на тяжёлых космических станциях типа "Протон".
Лит.: Григоров Н. Л., Мурзин В. С., Рапопорт И. Д., Метод измерения энергии частиц в области выше 1011eV, "Журнал экспериментальной и теоретической физики", 1958, т. 34, в. 2, с. 506; Бугаков В. В. [и др.], Принципы устройства научной аппаратуры для изучения космических лучей высокой энергии на космической станции "Протон-4", "Изв. АН СССР. Серия физическая", 1970, т. 34, с. 1818; Григоров Н. Л. [и др.], Ядерная лаборатория в космосе. Новый этап в изучении частиц сверхвысоких энергий, "Природа", 1965, № 12, с. 7.
Н. Л. Григоров.
Рис. 1. Схематическое изображение ионизационного калориметра в сочетании с ядерными фотоэмульсиями: 1 - мишень, в которой происходит взаимодействие космической частицы с атомными ядрами атомов мишени, приводящее к появлению γ-квантов высоких энергий; 2 - слои свинца, в которых γ-излучение порождает мощные лавины заряженных частиц; 3 - ядерные фотоэмульсии, регистрирующие эти лавины; 4 - слои вещества (железо или свинец), тормозящего лавины заряженных частиц; 5 - импульсные ионизационные камеры.

Рис. 2. Ионизационный калориметр, установленный на высокогорной станции на г. Арагац в Армении.
Ионизационный калориметр
ИЗМЕРИТЕЛЬНОЕ УСТРОЙСТВО, ИСПОЛЬЗУКМОЕ В ЭКСПЕРИМЕНТАХ В ОБЛАСТИ ЯДЕРНОЙ ФИЗИКИ И ФИЗИКИ ЭЛЕМЕНТАРНЫХ ЧАСТИЦ ДЛЯ ИЗМЕРЕНИЯ ЭНЕРГИИ ЧАСТИ
Калориметр (ядерная физика); Калориметр (физика элементарных частиц); Калориметр ионизационный; Гетерогенный калоример; Гетерогенные калоримеры; Семплинг-калориметр; Семплинг-калориметры; Сэмплинг-калориметр; Сэмплинг-калориметры; Гомогенный калоример; Гомогенные калоримеры; Электромагнитный калориметр; Электромагнитные калориметры; Адронный калориметр; Адронные калориметры
Ионизацио́нный калори́метр (от — тепло и …метр) в физике элементарных частиц и ядерной физике — прибор, который измеряет энергию частиц. Большинство частиц, попадающих в калориметр, при взаимодействии с его веществом инициируют возникновение вторичных частиц, передавая им часть своей энергии.
КАЛОРИМЕТРИЯ
и, мн. нет, ж.
1. Совокупность методов измерения количества теплоты, выделяемой или поглощаемой при физиче-ских, химических и биологических процессах.
2. биол. Методы измерения количества тепла, выделяемого организмом в процессе жизнедеятельно-сти за определенный промежуток времени. Калтриметрический - связанный с применением калори-метрии.
Википедия
Калориметр

Калори́метр (от лат. calor — тепло и metor — измерять) — прибор для измерения количества теплоты, выделяющейся или поглощающейся в каком-либо физическом, химическом или биологическом процессе. Термин «калориметр» был предложен А. Лавуазье и П. Лапласом (1780).
В физике элементарных частиц и ядерной физике используется ионизационный калориметр — прибор для измерения энергии частиц.




